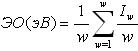2.6. Зависимость физических свойств минералов и других кристаллических веществ от электроотрицательности составляющих атомов
Понятие электроотрицательности атомов уже давно и плодотворно используется в химии и смежных с ней областях для решения многих теоретических и прикладных проблем (Бацанов, 2000). В настоящем разделе сделана попытка на основе электроотрицательности объяснить некоторые свойства кристаллов и тем самым продемонстрировать ее возможности в этой практически важной области.
Теоретические предпосылки использования электроотрицательности для объяснения механической, термической стабильности и других свойств минералов вполне очевидны. Характеризуя энергию связи электронов у атомов, вступающих в химическое взаимодействие в соединениях, параметры электроотрицательности могут определять энергию и соответственно прочность образующихся связей и стабильность соединений. При этом речь идет, разумеется, о координационных кристаллических соединениях с сильными межатомными связями (ионного, ковалентного или металлического типа).
Как известно, существуют многочисленные методы оценки и системы электроотрицательностей атомов (Бацанов, 1986; 2000), поэтому выбор соответствующей системы был далеко не простым. В результате испытания различных вариантов выяснилось, что для наших целей наиболее естественной и подходящей оказалась система, в которой электроотрицательность имеет размерность энергии (коль скоро речь идет об энергетическом подходе к оценке свойств кристаллов). Кроме того, эта система должна учитывать конкретные валентности атомов (см. раздел 1.2.2). Обоим указанным критериям вполне удовлетворяет предлагаемая автором система электроотрицательностей (таблица 2.15) и не удовлетворяют другие системы. Так, в системе Жанга (Zhang, 1982), учитывающей валентности металлов и неметаллов, электроотрицательность имеет размерность силы. А в системе Мартынова и Бацанова (Мартынов, Бацанов, 1980), в которой также учитывается валентность атомов, электроотрицательность имеет размерность корня квадратного из энергии, как и в оригинальной системе Полинга (Pauling, 1960). Заметим, кстати, что в последней, как и во всех системах кристаллических электроотрицательностей по С. С. Бацанову, не указывается валентность неметаллов, что, по нашему мнению (см. раздел 1.2.2), является серьезным упущением.
Используя величины электроотрицательностей атомов в соответствующих валентных состояниях из таблицы 2.12 и данные о различных физических свойствах гомоатомных кристаллов из источников, приведенных в разделе 2.1, были построены корреляционные зависимости (рис. 2.67-2.84) с выводом
следующих формул: твердости (относительной по минералогической шкале
НМ и абсолютной
HV по Викерсу), температуры плавления (
Тпл., К), скорости звука в кристаллах (
v), температурных коэффициентов линейного (α
l) и объемного (α
v) расширения, объемной сжимаемости (B), теплопроводности (λ), удельного сопротивления (ρ), модулей Юнга (
Е), сдвига (
G) и всестороннего объемного сжатия (
К), работы выхода электрона (φ), свободной поверхностной энергии (
Eshkl), пограничной межатомной плотности (ρ
min), максимальной частоты колебания атомов (v
m) и грамм-атомной теплоемкости для стандартных условий (
Ср).
Таблица 2.12
Электроотрицательности атомов (по В. В. Зуеву) для
различных валентных состояний и в различных единицах
| Атом (валентность) |
ЭО, эВ |
ЭО по шкале Ж.-П. |
ЭО, кДж/моль |
ЭО, кДж/г-а |
ЭО, кДж/см3 в твердом теле |
| H(I) |
13,6 |
2,58 |
1312,21 |
1301,87 |
98,94 |
| He(II) |
25,89 |
4,92 |
2498,02 |
624,1 |
- |
| Li(I) |
5,39 |
1,02 |
520,06 |
74,93 |
40,01 |
| Be(II) |
9,21 |
1,75 |
888,64 |
98,6 |
182,41 |
| B(III) |
11,17 |
2,12 |
1077,75 |
99,7 |
184,22 |
| C(IV) |
13,88 |
2,64 |
1339,23 |
111,5 |
391,7 |
| N(III) |
15,05 |
2,86 |
1452,11 |
103,67 |
106,36 |
| N(V) |
16,81 |
3,19 |
1621,93 |
115,8 |
- |
| O(II) |
15,59 |
2,96 |
1504,22 |
94,01 |
188,02 |
| O(IV) |
17,21 |
3,27 |
1660,52 |
103,78 |
- |
| O(VI) |
19,1 |
3,63 |
1842,88 |
115,18 |
- |
| F(I) |
17,42 |
3,31 |
1680,77 |
88,46 |
134,11 |
| F(III) |
18,6 |
3,53 |
1794,64 |
94,45 |
- |
| F(V) |
20,09 |
3,82 |
1938,40 |
102,02 |
- |
| F(VII) |
21,87 |
4,16 |
2110,15 |
111,06 |
- |
| Ne(VIII) |
25,83 |
4,91 |
2492,23 |
123,5 |
- |
| Na(I) |
5,14 |
0,98 |
495,94 |
21,56 |
20,93 |
| Mg(II) |
7,58 |
1,44 |
731,36 |
30,09 |
52,3 |
| Al(III) |
8,29 |
1,58 |
799,87 |
29,65 |
79,91 |
| Si(IV) |
9,69 |
1,84 |
934,95 |
33,29 |
77,53 |
| P(III) |
10,14 |
1,93 |
978,37 |
31,59 |
57,49 |
| P(V) |
11,25 |
2,14 |
1085,47 |
35,04 |
- |
| S(II) |
11,02 |
2,09 |
1063,28 |
33,16 |
68,64 |
| S(IV) |
11,36 |
2,16 |
1096,08 |
34,18 |
- |
| S(VI) |
12,44 |
2,36 |
1200,29 |
37,43 |
- |
| Cl(I) |
12,97 |
2,46 |
1251,42 |
35,3 |
71,65 |
| Cl(III) |
12,73 |
2,42 |
1228,27 |
34,65 |
- |
| Cl(V) |
13,01 |
2,47 |
1255,28 |
35,41 |
- |
| Cl(VII) |
13,92 |
2,64 |
1343,09 |
37,88 |
- |
| Ar(VIII) |
15,5 |
2,95 |
1495,53 |
37,44 |
- |
| K(I) |
4,34 |
0,82 |
418,75 |
10,71 |
9,23 |
| Ca(II) |
6,02 |
1,14 |
580,85 |
14,49 |
22,46 |
| Sc(III) |
7,09 |
1,35 |
684,09 |
15,22 |
45,51 |
| Ti(II) |
6,81 |
1,29 |
657,07 |
13,72 |
- |
| Ti(IV) |
8,45 |
1,61 |
815,30 |
17,02 |
77,27 |
| V(III) |
7,91 |
1,50 |
763,20 |
14,98 |
- |
| V(IV) |
8,94 |
1,7 |
862,58 |
16,93 |
- |
| V(V) |
9,76 |
1,85 |
941,7 |
18,49 |
112,97 |
| Cr(II) |
7,51 |
1,43 |
724,61 |
13,93 |
- |
| Cr(III) |
8,45 |
1,61 |
815,31 |
15,68 |
- |
| Cr(IV) |
9,52 |
1,81 |
918,55 |
17,66 |
- |
| Cr(VI) |
11,3 |
2,15 |
1090,29 |
20,97 |
150,77 |
| Mn(II) |
7,63 |
1,45 |
736,19 |
13,4 |
- |
| Mn(III) |
8,83 |
1,68 |
851,97 |
15,51 |
- |
| Mn(IV) |
9,93 |
1,89 |
958,11 |
17,44 |
129,75 |
| Mn(V) |
10,99 |
2,09 |
1060,38 |
19,3 |
143,6 |
| Mn(VII) |
12,66 |
2,41 |
1221,51 |
22,23 |
- |
| Fe(II) |
8,0 |
1,52 |
771,89 |
13,82 |
- |
| Fe(III) |
8,73 |
1,66 |
842,32 |
15,08 |
- |
| Fe(IV) |
10,05 |
1,91 |
969,68 |
17,36 |
136,69 |
| Fe(VI) |
12,19 |
2,32 |
1176,16 |
21,06 |
- |
| Fe(VIII) |
13,83 |
2,63 |
1334,4 |
23,89 |
391,8 |
| Co(II) |
8,19 |
1,56 |
790,22 |
13,41 |
- |
| Co(III) |
9,18 |
1,74 |
885,74 |
15,03 |
- |
| Co(IV) |
10,2 |
1,94 |
984,16 |
16,7 |
133,77 |
| Co(IX) |
15,05 |
2,86 |
1452,11 |
24,64 |
- |
| Ni(II) |
8,35 |
1,59 |
805,66 |
13,72 |
- |
| Ni(III) |
9,59 |
1,82 |
925,3 |
15,76 |
140,3 |
| Ni(IV) |
10,69 |
2,03 |
1031,44 |
17,57 |
156,41 |
| Ni(VIII) |
14,85 |
2,82 |
1432,82 |
24,41 |
- |
| Ni(X) |
16,34 |
3,1 |
1576,58 |
26,86 |
- |
| Cu(I) |
7,72 |
1,47 |
744,87 |
11,72 |
105,01 |
| Cu(II) |
8,93 |
1,7 |
861,62 |
13,56 |
- |
| Cu(III) |
10,05 |
1,91 |
969,68 |
15,26 |
136,73 |
| Cu(V) |
12,3 |
2,34 |
1186,78 |
18,68 |
- |
| Cu(VII) |
14,01 |
2,66 |
1351,77 |
21,27 |
- |
| Zn(II) |
9,18 |
1,74 |
885,74 |
13,55 |
96,65 |
| Zn(VI) |
13,88 |
2,64 |
1339,23 |
20,48 |
- |
| Ga(III) |
8,83 |
1,68 |
851,97 |
12,22 |
72,18 |
| Ge(IV) |
9,67 |
1,84 |
933,02 |
12,85 |
68,4 |
| As(III) |
9,53 |
1,81 |
919,51 |
12,27 |
70,92 |
| As(V) |
10,74 |
2,04 |
1036,26 |
13,83 |
- |
| Se(II) |
10,17 |
1,93 |
981,26 |
12,43 |
59,54 |
| Se(IV) |
10,43 |
1,98 |
1006,35 |
12,75 |
- |
| Se(VI) |
11,54 |
2,19 |
1113,45 |
14,1 |
- |
| Br(V) |
11,69 |
2,22 |
1127,92 |
14,12 |
- |
| Br(VII) |
12,55 |
2,38 |
1210,9 |
15,15 |
- |
| Kr(VIII) |
13,67 |
2,6 |
1318,96 |
15,74 |
- |
| Rb(I) |
4,18 |
0,79 |
403,31 |
4,72 |
7,23 |
| Sr(II) |
5,6 |
1,06 |
540,32 |
6,17 |
15,67 |
| Y(III) |
6,44 |
1,22 |
621,37 |
6,99 |
31,24 |
| Zr(IV) |
7,51 |
1,43 |
724,61 |
7,94 |
51,66 |
| Nb(III) |
7,73 |
1,47 |
745,84 |
8,03 |
- |
| Nb(IV) |
8,19 |
1,56 |
790,22 |
8,51 |
- |
| Nb(V) |
8,56 |
1,63 |
825,92 |
8,89 |
68,82 |
| Mo(IV) |
9,12 |
1,73 |
879,95 |
9,17 |
93,72 |
| Mo(VI) |
9,98 |
1,9 |
962,93 |
10,04 |
102,61 |
| Tc(V) |
9,57 |
1,82 |
923,37 |
9,34 |
107,41 |
| Tc(VII) |
10,56 |
2,01 |
1018,89 |
10,3 |
118,45 |
| Ru(II) |
7,83 |
1,49 |
755,49 |
7,47 |
- |
| Ru(III) |
8,59 |
1,63 |
828,81 |
8,2 |
- |
| Ru(IV) |
9,38 |
1,78 |
905,04 |
8,95 |
110,71 |
| Ru(VI) |
10,62 |
2,02 |
1024,68 |
10,14 |
125,43 |
| Ru(VIII) |
11,6 |
2,2 |
1119,24 |
11,07 |
- |
| Rh(II) |
7,71 |
1,46 |
743,91 |
7,23 |
- |
| Rh(III) |
8,78 |
1,67 |
847,15 |
8,23 |
- |
| Rh(IV) |
9,46 |
1,8 |
912,76 |
8,87 |
110,08 |
| Pd(II) |
9,02 |
1,71 |
870,3 |
8,18 |
98,32 |
| Pd(IV) |
10,32 |
1,96 |
995,74 |
9,36 |
112,51 |
| Ag(I) |
7,57 |
1,43 |
730,4 |
6,77 |
71,08 |
| Ag(II) |
9,16 |
1,74 |
883,81 |
8,19 |
- |
| Ag(III) |
10,12 |
1,92 |
976,44 |
9,05 |
95,03 |
| Cd(II) |
8,72 |
1,66 |
841,36 |
7,48 |
64,7 |
| In(III) |
8,18 |
1,55 |
789,25 |
6,87 |
50,22 |
| Sn(II) |
7,33 |
1,39 |
707,24 |
5,96 |
43,57 |
| Sn(IV) |
9,12 |
1,73 |
879,95 |
7,41 |
- |
| Sb(III) |
8,42 |
1,6 |
812,41 |
6,67 |
44,63 |
| Sb(V) |
9,81 |
1,86 |
946,53 |
7,77 |
- |
| Te(II) |
9,15 |
1,74 |
882,85 |
6,92 |
43,18 |
| Te(IV) |
9,54 |
1,81 |
920,48 |
7,21 |
- |
| Te(VI) |
10,86 |
2,06 |
1047,84 |
8,21 |
- |
| I(III) |
10,33 |
1,96 |
996,7 |
7,85 |
- |
| I(V) |
11,14 |
2,12 |
1074,85 |
8,47 |
- |
| I(VII) |
12,06 |
2,29 |
1163,62 |
9,17 |
- |
| Xe(VIII) |
12,65 |
2,4 |
1220,55 |
9,3 |
- |
| Cs(I) |
3,89 |
0,74 |
375,33 |
2,82 |
5,28 |
| Ba(II) |
5,41 |
1,03 |
521,99 |
3,8 |
13,66 |
| La(III) |
5,91 |
1,12 |
570,23 |
4,11 |
25,26 |
| Ce(III) |
6,44 |
1,22 |
621,37 |
4,43 |
36,5 |
| Ce(IV) |
7,12 |
1,35 |
686,98 |
4,9 |
- |
| Pr(III) |
5,97 |
1,13 |
576,02 |
4,09 |
27,7 |
| Nd(III) |
6,07 |
1,15 |
585,67 |
4,06 |
28,45 |
| Pm(III) |
6,14 |
1,17 |
592,42 |
4,09 |
29,53 |
| Sm(III) |
6,32 |
1,2 |
609,79 |
4,05 |
30,46 |
| Eu(II) |
5,64 |
1,07 |
544,18 |
3,58 |
- |
| Eu(III) |
6,51 |
1,24 |
628,12 |
4,13 |
21,65 |
| Gd(III) |
6,36 |
1,21 |
613,65 |
3,9 |
30,81 |
| Tb(III) |
6,3 |
1,2 |
607,86 |
3,82 |
31,43 |
| Dy(III) |
6,45 |
1,23 |
622,33 |
3,83 |
32,75 |
| Ho(III) |
6,51 |
1,24 |
628,12 |
3,81 |
33,51 |
| Er(II) |
6,03 |
1,15 |
581,81 |
3,48 |
31,55 |
| Tm(III) |
6,7 |
1,27 |
646,46 |
3,83 |
35,7 |
| Yb(II) |
6,17 |
1,17 |
595,32 |
3,44 |
23,96 |
| Yb(III) |
6,95 |
1,32 |
670,58 |
3,88 |
- |
| Lu(III) |
6,46 |
1,23 |
623,3 |
3,56 |
35,03 |
| Hf(IV) |
7,95 |
1,51 |
767,06 |
4,3 |
57,23 |
| Ta(III) |
7,71 |
1,46 |
743,91 |
4,11 |
- |
| Ta(V) |
8,08 |
1,53 |
779,61 |
4,31 |
71,78 |
| W(IV) |
8,4 |
1,6 |
810,48 |
4,41 |
- |
| W(VI) |
8,89 |
1,69 |
857,76 |
4,67 |
90,13 |
| Re(V) |
8,91 |
1,69 |
859,69 |
4,62 |
- |
| Re(VI) |
9,23 |
1,75 |
890,57 |
4,78 |
100,48 |
| Re(VII) |
9,52 |
1,81 |
918,55 |
4,93 |
- |
| Os(II) |
8,6 |
1,63 |
829,78 |
4,36 |
- |
| Os(IV) |
8,88 |
1,69 |
856,8 |
4,5 |
101,65 |
| Os(VI) |
9,58 |
1,82 |
924,34 |
4,86 |
109,79 |
| Os(VIII) |
10,32 |
1,96 |
995,74 |
5,24 |
- |
| Ir(III) |
8,9 |
1,69 |
858,73 |
4,47 |
- |
| Ir(IV) |
9,11 |
1,73 |
878,99 |
4,57 |
102,46 |
| Ir(VI) |
9,96 |
1,89 |
961,0 |
5,0 |
112,1 |
| Pt(II) |
9,11 |
1,73 |
878,99 |
4,51 |
- |
| Pt(IV) |
9,54 |
1,81 |
920,48 |
4,72 |
101,24 |
| Pt(VI) |
10,27 |
1,95 |
990,91 |
5,08 |
108,97 |
| Au(I) |
9,22 |
1,75 |
889,6 |
4,52 |
87,33 |
| Au(II) |
9,74 |
1,85 |
939,77 |
4,77 |
92,16 |
| Au(III) |
9,82 |
1,86 |
947,5 |
4,81 |
92,93 |
| Hg(I) |
10,44 |
1,98 |
1007,31 |
5,02 |
68,0 |
| Hg(II) |
9,91 |
1,88 |
956,18 |
4,77 |
64,61 |
| Tl(I) |
6,11 |
1,16 |
589,53 |
2,88 |
34,13 |
| Tl(III) |
8,75 |
1,66 |
844,25 |
4,13 |
48,95 |
| Pb(II) |
7,46 |
1,42 |
719,79 |
3,47 |
39,38 |
| Pb(IV) |
8,83 |
1,68 |
851,97 |
4,11 |
- |
| Bi(III) |
8,47 |
1,61 |
817,23 |
3,91 |
38,12 |
| Bi(V) |
9,59 |
1,82 |
925,3 |
4,43 |
- |
| Po(II) |
9,07 |
1,72 |
875,13 |
4,19 |
39,05 |
| Po(IV) |
9,18 |
1,74 |
885,74 |
4,24 |
- |
| Po(VI) |
10,15 |
1,93 |
979,33 |
4,69 |
- |
| At(VII) |
10,78 |
2,05 |
1040,12 |
4,95 |
- |
| Rn(VIII) |
11,52 |
2,19 |
1111,52 |
5,01 |
- |
| Fr(I) |
3,98 |
0,76 |
384,01 |
1,72 |
- |
| Ra(II) |
5,18 |
0,98 |
499,8 |
2,21 |
19,01 |
| Ac(III) |
6,4 |
1,22 |
617,51 |
2,72 |
27,36 |
| Th(IV) |
6,87 |
1,31 |
662,86 |
2,86 |
33,52 |
| U(IV) |
7,81 |
1,48 |
753,55 |
3,17 |
60,07 |
| U(VI) |
9,26 |
1,76 |
892,5 |
3,75 |
71,05 |
| Np(III) |
6,36 |
1,21 |
613,65 |
2,59 |
52,45 |
ПРИМЕЧАНИЕ. Величины электроотрицательностей атомов вычислены из соответствующих потенциалов ионизации по формуле (Зуев, 1990):
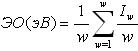
где w - валентность атома, Iw - потенциал ионизации соответствующей валентности.
Перевод полученных по этой формуле величин из электрон-вольтов в относительные электроотрицательности по шкале Жанга-Полинга (Zhang, 1982) осуществлен посредством коэффициента 0,19 (рис. 2.67), а в единицы кДж/моль - посредством коэффициента 96,486 кДж/моль.
Делением на атомные веса элементов (М, г/моль) величины ЭО кДж/моль трансформированы в величины ЭО кДж/г, которые умножением на плотность (ρ, г/см3) гомоатомного кристалла переведены в величины ЭО кДж/см3.
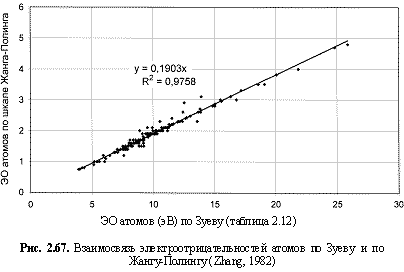
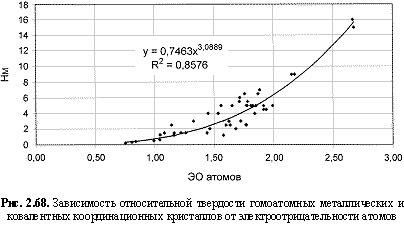
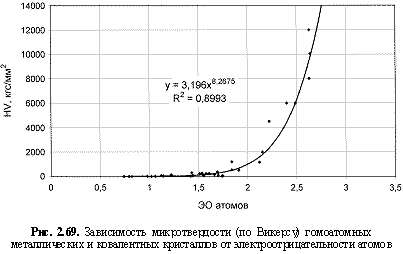
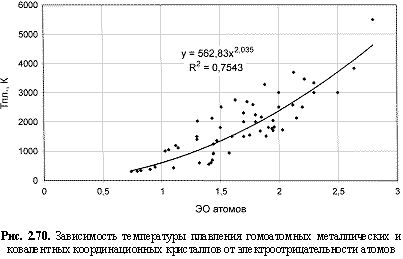
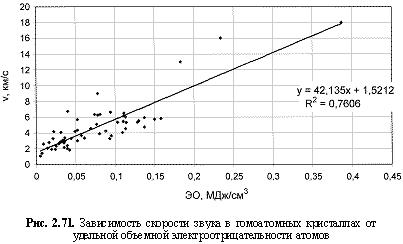
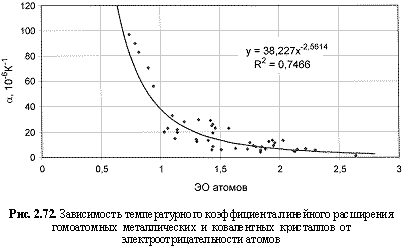
НМ = 0,75ЭО3; (2.110)
HV (кгс/мм2) = 3,2ЭО8.27; (2.111)
Тпл., К = 563ЭО2; (2.112)
v (км/с) = 42,14ЭО(МДж/см3) + 1,52; (2.113)
αl (10-6 K-1) = 38,23ЭО-2.56; (2.114)
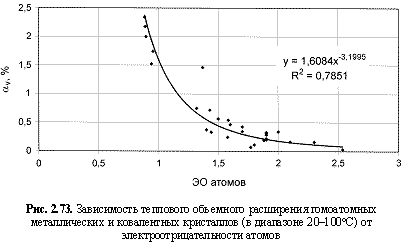
αv (%) = 1,61ЭО-3.2; (2.115)
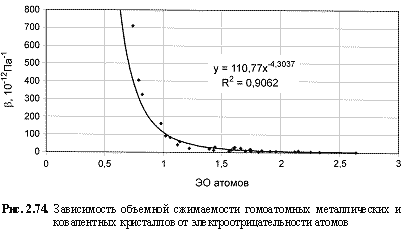
B (10-12 Па-1) = 120,4ЭО-4.53; (2.116)
λ (Вт/(м∙К)) = 1653ЭО(МДж/см3); (2.117)
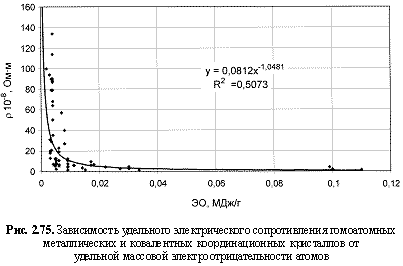
ρ (10-8 Ом∙м) = 0,08[ЭО(МДж/г)]-1.05; (2.118)
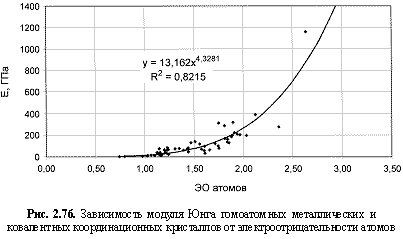
Е (ГПа) = 12,96ЭО4.5; (2.119)
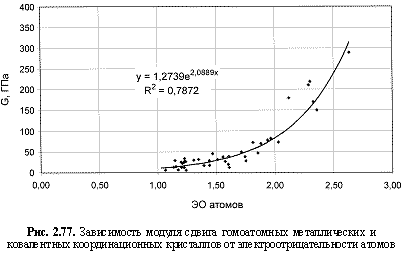
G (ГПа) = 1,274е2.09ЭО; (2.120)
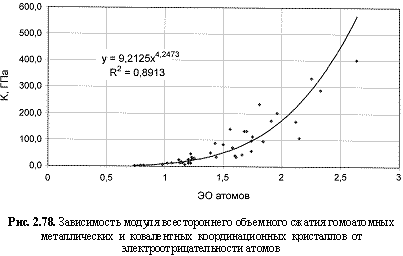
К (ГПа) = 9,21ЭО4.25; (2.121)
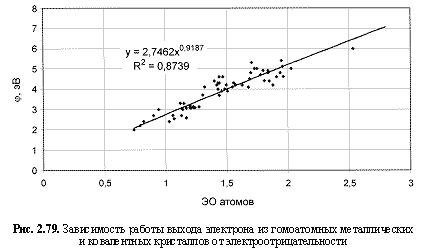
φ (эВ) = 2,75ЭО0.92; (2.122)
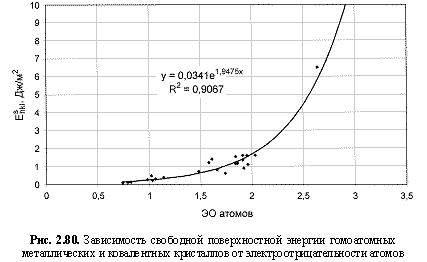
Eshkl (Дж/м2) = 0,034е1.95ЭО; (2.123)
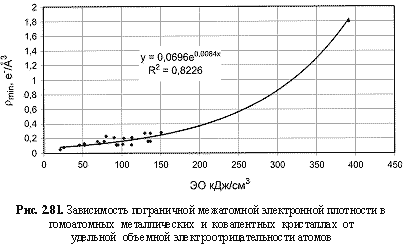
ρmin (e-/Å3) = 0,07е0.0084ЭО(кДж/см3); (2.124)
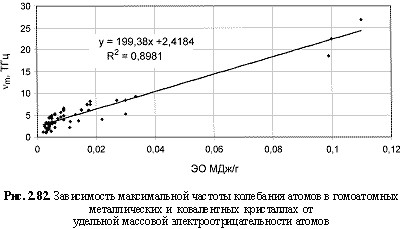
vm (ТГц) = 199,4ЭО(МДж/г) + 2,42; (2.125)
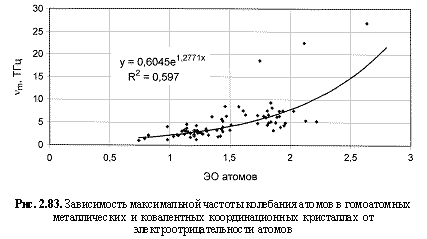
vm (ТГц) = 0,605е1.28ЭО; (2.126)
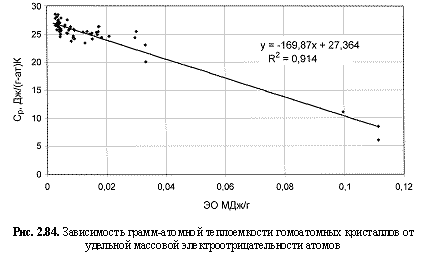
Ср (Дж/(г-а)К) = -170ЭО(МДж/г) + 27,36. (2.127)
Обратим внимание на то, что в выведенных формулах, обеспечивающих довольно высокие параметры достоверности аппроксимации
R2, фигурируют различные электроотрицательности (таблица 2.12): относительные (безразмерные) в шкале Жанга-Полинга (
ЭО), удельные массовые (
ЭО МДж/г) и удельные объемные (
ЭО МДж/см
3 или
ЭО кДж/см3). Именно поэтому размерности электроотрицательностей указаны в формулах (что обычно не практикуется в научных изданиях). Использование удельных величин электроотрицательностей повышает достоверность аппроксимации
R2, что следует из сравнения двух формул максимальной частоты колебаний атомов в кристаллах (рис. 2.82 и 2.83). Понятно, что получение удельных электроотрицательностей в соответствующих единицах возможно лишь при условии, если исходная электроотрицательность имеет размерность энергии (эВ). По этой причине и была выбрана шкала энергетических (ионизационных) электроотрицательностей атомов (таблица 2.12).
Предлагаемые формулы с достоверностью до 80-90% позволяют оценивать свойства
гомоатомных координационных кристаллических соединений.
Оценка свойств более сложных
гетероатомных кристаллических соединений с применением электроотрицательностей атомов в принципе также возможна, но представляет отдельную самостоятельную проблему, которая здесь подробно не рассматривается и будет продемонстрирована лишь на двух примерах - вычисления твердости и температуры плавления.
Для оценки твердости гетероатомных кристаллических соединений необходимо внести следующие два изменения в формулу (2.110). Во-первых, в качестве параметра электроотрицательности сложного соединения рекомендуется вычислять среднегеометрическую величину <
ЭО> из электроотрицательностей атомов, образующих это соединение. Например, для кристалла А
nB
m <
ЭО> = (
ЭОnA∙
ЭОmB)
1/(n+m). И, во-вторых, в силу различия электроотрицательностей атомов гетероатомного соединения и соответственно отклонения химической связи от ковалентного типа предлагается учесть степень ковалентности в форме соответствующего параметра
р*, и формула (2.110) трансформируется в формулу:
HM = 0,75ЭО3р*. (2.128)
В результате многочисленных расчетов было установлено, что
р* = (1-
fi2)
1/2 для кристаллов, удовлетворяющих условию 0,6≤
fi<1, и
р* = (1-
fi) для кристаллов, удовлетворяющих условию 0,6>
fi>0 (
fi - степень ионности соединений).
Важно подчеркнуть, что обе формулы, строго говоря, применимы к координационным кристаллам с ковалентными, ионными и металлическими межатомными связями и не применимы к молекулярным соединениям, обладающим островным, цепочечным или слоистым мотивами структур. По известному кристаллохимическому правилу твердость подобных кристаллов определяется прочностью слабых молекулярных связей, поскольку при разрушении таких кристаллов прочные межатомные связи не нарушаются.
В качестве примера вычислим твердость форстерита Mg
2SiO
4, который лишь формально относится к островным силикатам, а фактически является сложным координационным кристаллическим соединением. Приняв
ЭО(Mg) = 1,44,
ЭО(Si) = 1,84,
ЭО(O) = 3,27 и
fi = 0,7, находим <
ЭО> = (1,44
2x1,84x3,27
4)
1/7 = 2,38 и далее по формуле (2.128) -
НМ = 0,75x2,38
3(1-0,72)
1/2 = 7,2 что находится в удовлетворительном согласии со справочной величиной (около 7,0 по разным источникам).
В случае циркона ZrSiO
4 c параметрами
ЭО(Zr) = 1,43,
ЭО(Si) = 1,84,
ЭО(О) = 3,27 и
fi = 0,8 находим <
ЭО> = (1,43x1,84x3,27
4)
1/6 = 2,59 и
НМ = 7,8, что близко к справочной твердости циркона (7,5).
И еще один, более сложный пример. Для гроссуляра Ca
3Al
2Si
3O
12 с использованием
ЭО(Са) = 1,14,
ЭО(Al) = 1,58,
ЭО(Si) = 1,84,
ЭО(О) = 3,27 и
fi = 0,7 находим <
ЭО> = 2,38 и
НМ = 7,2 (справочная твердость 7-7,5). Другие примеры вычисления твердости кристаллов по предлагаемой методике приведены в таблице 2.13.
Таблица 2.13
Результаты расчета твердости и температуры плавления координационных и квазикоординационных (слабо анизодесмических) кристаллов с высокими параметрами ионности (fi≥0,6)
| Кристалл |
<ЭО> |
fi |
НМ |
Тпл, К |
| Расчет |
Эксперимент |
Расчет |
Эксперимент |
| LiH |
1,8 |
0,7 |
3,1 |
3,5 |
1303 |
- |
| NaH |
1,78 |
0,8 |
2,5 |
2,5-3 |
1070 |
- |
| MgH2 |
2,2 |
0,9 |
3,5 |
3,5-4 |
1188 |
- |
| CaH2 |
2,1 |
0,94 |
2,4 |
2,5 |
847 |
814 |
| LiF |
2,275 |
0,9 |
3,8 |
4 |
1270 |
1122 |
| LiCl |
1,745 |
0,8 |
2,4 |
2,5 |
1029 |
883 |
| LiBr |
1,62 |
0,75 |
2,1 |
2-2,5 |
977 |
823 |
| NaF |
2,255 |
0,9 |
3,7 |
3,5 |
1248 |
1253 |
| NaCl |
1,725 |
0,85 |
2 |
2 |
883 |
1043 |
| NaBr |
1,6 |
0,8 |
1,8 |
2 |
865 |
1020 |
| NaI |
1,55 |
0,75 |
1,85 |
2 |
895 |
934 |
| KCl |
1,645 |
0,85 |
1,75 |
1,75 |
751 |
1049 |
| KBr |
1,52 |
0,75 |
1,74 |
1,75 |
860 |
1007 |
| AgF |
2,25 |
0,97 |
2,1 |
2-2,5 |
693 |
708 |
| AgCl |
1,95 |
0,93 |
2 |
2 |
786 |
728 |
| AgBr |
1,825 |
0,93 |
1,7 |
2 |
689 |
701 |
| AgI |
1,775 |
0,9 |
1,8 |
1,5-2 |
773 |
800 |
| CsI |
1,43 |
0,8 |
1,3 |
1-1,5 |
691 |
905 |
| TlF |
2,02 |
0,95 |
1,9 |
2,0 |
717 |
595 |
| TlBr |
1,605 |
0,85 |
1,6 |
1,5 |
764 |
733 |
| TlI |
1,57 |
0,85 |
1,5 |
1,5 |
731 |
714 |
| MgF2 |
2,83 |
0,95 |
5,3 |
4,5-5 |
1407 |
1536 |
| MnF2 |
2,62 |
0,96 |
3,8 |
4,0 |
1082 |
1133 |
| FeF2 |
2,66 |
0,94 |
4,8 |
4,5 |
1359 |
1373 |
| CaF2 |
2,73 |
0,95 |
4,8 |
4 |
1310 |
1543 |
| CaCl2 |
2,03 |
0,9 |
2,7 |
2,5 |
1011 |
1045 |
| YF3 |
2,71 |
0,94 |
5,1 |
4,0-5,0 |
1411 |
1428 |
| YCl3 |
2,07 |
0,9 |
2,9 |
3,0 |
1051 |
994 |
| YI3 |
1,85 |
0,75 |
3,1 |
3,0 |
1274 |
1270 |
| FeF3 |
2,92 |
0,96 |
5,2 |
5,0 |
1344 |
1300 |
| SiO2 |
2,25 |
0,72 |
5,9 |
6,0 |
1978 |
1973 |
| Cu2O |
2,19 |
0,85 |
4,1 |
4,0 |
1422 |
1502 |
| CuO |
2,36 |
0,9 |
4,3 |
4,5 |
1367 |
1360 |
| ZnO |
2,38 |
0,85 |
5,3 |
5,0 |
1680 |
1533 (разл.) |
| BeO |
2,39 |
0,6 |
8,2 |
7,0-9,0 |
2573 |
2763 |
| MgO |
2,17 |
0,6 |
6,1 |
6,0 |
2121 |
2800 |
| MnO |
2,36 |
0,85 |
5,2 |
5-5,5 |
1652 |
1923 |
| NiO |
2,43 |
0,8 |
6,5 |
6 |
1995 |
2263 |
| CdO |
2,33 |
0,85 |
5,0 |
5,0 |
1610 |
1500 |
| TiO2 |
2,58 |
0,85 |
6,8 |
7,0 |
1974 |
2098 |
| SnO2 |
2,64 |
0,85 |
7,3 |
7,0 |
2067 |
1943 |
| UO2 |
2,43 |
0,8 |
6,5 |
6,5 |
1995 |
1461 |
| Al2O3 |
2,594 |
0,75 |
8,7 |
9 |
2506 |
2323 |
| Ti2O3 |
2,37 |
0,75 |
6,6 |
6,5 |
2092 |
2103 |
| Cr2O3 |
2,46 |
0,7 |
8,0 |
8,5 |
2433 |
2335 |
| V2O3 |
2,39 |
0,7 |
7,3 |
7,5 |
2297 |
2243 |
| Fe2O3 |
2,49 |
0,85 |
6,1 |
6,5 |
1839 |
1838 |
| Mn2O3 |
2,505 |
0,8 |
7,1 |
7,0 |
2120 |
- |
| Bi2O3 |
2,46 |
0,95 |
3,5 |
4,0 |
1064 |
1093 |
| Ce2O3 |
2,2 |
0,6 |
6,4 |
6,5 |
2180 |
2453 |
| Fe3O4 |
2,41 |
0,85 |
5,5 |
5,0-6,0 |
1723 |
1813 |
| Mn3O4 |
2,41 |
0,83 |
5,9 |
6,0 |
1824 |
1833 |
| BeAl2O4 |
2,62 |
0,8 |
8,1 |
8,5 |
2319 |
2143 |
| MgAl2O4 |
2,526 |
0,75 |
8 |
8 |
2376 |
2385 |
| ZnAl2O4 |
2,57 |
0,8 |
7,6 |
8 |
2231 |
2223 |
| FeCr2O4 |
2,546 |
0,83 |
6,9 |
6,75 |
2036 |
2123 |
| CaFe2O4 |
2,32 |
0,85 |
4,9 |
5,0 |
1596 |
1580 |
| CaTiO3 |
2,3 |
0,7 |
6,5 |
6,5 |
2127 |
2233 |
| MgTiO3 |
2,57 |
0,87 |
6,9 |
7,0 |
1949 |
1903 |
| MnTiO3 |
2,41 |
0,85 |
6,9 |
6,5-7,0 |
1723 |
1677 |
| FeTiO3 |
2,43 |
0,85 |
5,7 |
6,25 |
1751 |
1673 |
| MgSiO3 |
2,47 |
0,85 |
6,0 |
6,5 |
1809 |
1847 |
| CaSiO3 |
2,36 |
0,85 |
5,2 |
5,5 |
1652 |
1817 |
| CaMgSi2O6 |
2,42 |
0,85 |
5,6 |
6,0 |
1737 |
1664 |
| FeWO4 |
2,41 |
0,85 |
5,5 |
5,5 |
1722 |
- |
| MgWO4 |
2,39 |
0,85 |
5,4 |
5,5 |
1694 |
1633 |
| Be2SiO4 |
2,52 |
0,8 |
7,2 |
7,5 |
2145 |
2033 |
| Na2SiO3 |
1,99 |
0,8 |
3,5 |
3,5 |
1338 |
1361 |
| Al2SiO5 |
2,54 |
0,85 |
6,5 |
6,0-7,0 |
1913 |
1703 |
| Y2SiO5 |
2,38 |
0,75 |
6,7 |
6,5 |
2109 |
2253 |
| Al6Si2O13 |
2,56 |
0,8 |
7,5 |
7,5-8,0 |
2214 |
2208 |
| MnMn6SiO12 |
2,5 |
0,85 |
6,2 |
6,5 |
1854 |
1673 |
| Al2SiO4F2 |
2,65 |
0,82 |
8,0 |
8,0 |
2263 |
1500 (разл.) |
| Mg7Si8O22(OH)2 |
2,49 |
0,83 |
6,5 |
6,5 |
1947 |
1973 |
| KMg3AlSi3O10(OH)2 |
2,35 |
0,85 |
¾ |
¾ |
1638 |
1603 |
ПРИМЕЧАНИЕ. В расчетах по формулам (2) и (4) параметр ковалентности принят равным p* = (1-fi2)1/2.
Аналогичным образом можно оценивать температуры плавления гетероатомных (сложных) кристаллов с учетом среднегеометрической электроотрицательности атомов и параметра ковалентности:
Тпл., К = 563ЭО2р*, (2.129)
где параметр ковалентности
р* принимает в зависимости от ионности
fi те же значения, что и в формуле (2.128).
Расчеты температур плавления по этой формуле приведены в таблице 2.13.
В таблице 2.14 даны примеры оценки относительной твердости и температуры плавления для комплексных кристаллических соединений, а в таблице 2.15 - для кристаллов (главным образом сульфидов и их аналогов) с параметрами ионности
fi<0,6.
Таблица 2.14
Результаты расчетов относительной твердости и температуры плавления комплексных кристаллов (с островным мотивом структуры)
| Кристалл |
<ЭО> |
fi |
НМ |
Тпл, К |
| Расчет |
Эксперимент |
Расчет |
Эксперимент |
| K[BF4] |
2,54 |
0,97 |
3,0 |
3,0 |
883 |
843 |
| K2[BeF4] |
2,1 |
0,9 |
3,0 |
3,0 |
1063 |
1082 |
| K2[SiF6] |
2,37 |
0,95 |
3,1 |
3,0 |
987 |
1146 |
| K2[PtBr6] |
1,74 |
0,915 |
1,6 |
2,0 |
688 |
673 (разл.) |
| K[MnO4] |
2,31 |
0,99 |
1,3 |
1,0-1,5 |
424 |
473 |
| K[NO3] |
2,32 |
0,98 |
1,9 |
2,0 |
603 |
608 |
| K[CN] |
1,835 |
0,88 |
2,2 |
2,0 |
900 |
893 |
| Na3[AlF6] |
2,22 |
0,9 |
3,6 |
3,5 |
1209 |
1283 |
| Na2[SiF6] |
2,47 |
0,95 |
3,5 |
3,5 |
1073 |
1119 |
| Na[ClO3] |
2,29 |
0,98 |
1,8 |
2,0 |
587 |
536 |
| Na[ClO4] |
2,415 |
0,97 |
2,6 |
2,5-3,0 |
798 |
742 |
| Na[NO3] |
2,4 |
0,985 |
1,8 |
2,0 |
560 |
580 |
| Na[IO4] |
2,36 |
0,97 |
2,4 |
2,5 |
762 |
742 |
| Na2[CO3] |
2,0 |
0,86 |
3,1 |
2,0-3,0 |
1149 |
1131 |
| Na2[SO4] |
2,09 |
0,9 |
3,0 |
3,0 |
1072 |
1157 |
| Na2[CrO4] |
2,06 |
0,9 |
2,9 |
3,0 |
1041 |
1067 |
| Na4[SiO4] |
1,72 |
0,6 |
3,0 |
3,0 |
1332 |
1393 |
| Na[CN] |
1,95 |
0,92 |
2,2 |
2,0 |
839 |
837 |
| Ag[NO3] |
2,6 |
0,992 |
1,7 |
1,5 |
480 |
483 |
| Ag2[CO3] |
2,28 |
0,985 |
1,5 |
1,5 |
505 |
473 |
| Ag2[SO4] |
2,33 |
0,95 |
3,0 |
2,5-3,0 |
954 |
933 |
| Ag3[PO4] |
2,16 |
0,9 |
3,3 |
3,0-3,5 |
1145 |
1122 |
| Ca[CO3] |
2,39 |
0,95 |
3,2 |
3,0-3,5 |
1004 |
900 (разл.) |
| Ca[SO4] |
2,43 |
0,9 |
4,7 |
4,0 |
1449 |
1733 |
| Ca[MoO4] |
2,345 |
0,82 |
5,5 |
5,0 |
1772 |
1793 |
| Ca[WO4] |
2,3 |
0,8 |
5,5 |
5,0 |
1787 |
1853 |
| Ca5[PO4]3F |
2,27 |
0,8 |
5,3 |
5,0 |
1741 |
1823 |
| Mg[SO4] |
2,53 |
0,92 |
4,7 |
4,5 |
1412 |
1410 |
| Mn[SO4] |
2,53 |
0,96 |
3,4 |
3,5 |
1009 |
973 |
| Ni[SO4] |
2,57 |
0,95 |
4,0 |
4,0 |
1161 |
1113 |
| Pb[SO4] |
2,52 |
0,92 |
4,7 |
4,5 |
1401 |
1443 |
| Pb[CrO4] |
2,48 |
0,95 |
3,6 |
3,5 |
1081 |
1117 |
| Pb[WO4] |
2,385 |
0,9 |
4,4 |
4,5 |
1396 |
1396 |
| Pb5[PO4]3Cl |
2,35 |
0,88 |
4,6 |
4,5 |
1477 |
1429 |
| Fe2[SO4]3 |
2,66 |
0,98 |
2,8 |
3,0 |
793 |
873 (разл.) |
| Zn[SO4] |
2,61 |
0,95 |
4,1 |
4,25 |
1197 |
1103 |
Таблица 2.15
Результаты расчетов относительной твердости и температуры плавления кристаллических соединений, характеризующихся параметрами ионности fi<0,6
| Кристалл |
<ЭО> |
fi |
НМ |
Тпл, К |
| Расчет |
Эксперимент |
Расчет |
Эксперимент |
| SiO2 кварц |
2,7 |
0,55 |
6,6 |
7,0 |
1847 |
1943 |
| SiO2 стишовит |
2,7 |
0,75 |
9,4 |
9,0 |
2715 |
≡3000 |
| ZnS |
2,03 |
0,37 |
4,0 |
4,0 |
1462 |
1373 (разл.) |
| CdS |
1,98 |
0,4 |
3,5 |
3,5 |
1324 |
- |
| PbS |
1,9 |
0,45 |
2,8 |
2,5-3,0 |
1118 |
1387 (разл.) |
| PbSe |
1,82 |
0,40 |
2,7 |
2,5-3,0 |
1119 |
1338 |
| PbTe |
1,74 |
0,35 |
2,6 |
2,5-3,0 |
1108 |
1190 |
| NiS |
2,09 |
0,5 |
3,4 |
3,5 |
1230 |
1070 |
| NiAs |
2,0 |
0,45 |
3,3 |
3,5 |
1239 |
1237 |
| NiSb |
1,89 |
0,3 |
3,5 |
3,5 |
1408 |
1433 |
| FeS |
2,03 |
0,4 |
3,8 |
4,0 |
1392 |
1443 |
| FeS2 |
2,14 |
0,2 |
5,9 |
6,5 |
2063 |
1973 |
| NiS2 |
2,18 |
0,3 |
5,4 |
6,0 |
1873 |
1081 (разл.) |
| MoS2 |
2,07 |
0,33 |
¾ |
¾ |
1616 |
1573 (разл.) |
| SiS2 |
2,0 |
0,4 |
¾ |
¾ |
1351 |
1373 |
| Cu2S |
1,99 |
0,5 |
3,0 |
3,0 |
1115 |
1403 |
| Cu2Se |
1,93 |
0,45 |
3,0 |
3,0 |
1153 |
1113 |
| Ag2S |
1,99 |
0,5 |
3,0 |
2,5 |
1115 |
1113 |
| Ag2Te |
1,88 |
0,4 |
3,0 |
2,5 |
1194 |
1229 |
| In2S3 |
1,995 |
0,4 |
3,6 |
4,0 |
1344 |
1363 |
| Cu3As |
1,94 |
0,45 |
3,0 |
3,0 |
1165 |
1103 |
| Cu3Sb |
1,9 |
0,5 |
2,6 |
3,0 |
1016 |
960 |
| CuFeS2 |
2,08 |
0,4 |
4,0 |
4,0 |
1461 |
1273 |
| Cu5FeS4 |
2,03 |
0,4 |
3,8 |
3,5-4,0 |
1392 |
1408 |
| Ag5SbS4 |
2,0 |
0,5 |
3,0 |
3,0 |
1126 |
763 (разл.) |
| Ag16Sb2S11 |
1,96 |
0,5 |
2,8 |
3,0 |
1081 |
1223 |
| Cu12Sb4S13 |
2,01 |
0,5 |
3,0 |
3-4 |
1137 |
973 |
| CuPbBiS3 |
1,97 |
0,57 |
2,5 |
2,5 |
939 |
793 |
ПРИМЕЧАНИЕ. В расчетах по формулам (2.128) и (2.129) параметр ковалентности кристаллов принят равным р* = (1-fi) за исключением стишовита SiO2, для которого р* = (1-fi2)1/2, как и для всех других кристаллов с высокими параметрами ионности (см. таблице 2.13). Для слоистого MoS2 и цепочечного SiS2 кристаллов, твердость которых определяется молекулярными связями между слоями и цепочками, оценка твердости невозможна.
В качестве комментариев к таблицах 2.13-2.15 отметим следующие. При вычислении по данным таблицы 2.12 параметров
ЭО валентные состояния атомов в кристаллах принимались согласно полученным в разделе 1.2.2 обоснованиям (с учетом металлических связей в сульфидах и их аналогах). Параметры ионности связей (
fi) подобраны так, чтобы расчетные твердости и температуры плавления кристаллов находились в удовлетворительном согласии с соответствующими экспериментальными данными.
В случае сложных координационных соединений принятые параметры
fi являются интегрально усредненными параметрами ионности связей всех катионных компонентов с анионами.
Для комплексных соединений принятые параметры ионности связей относятся, как это очевидно, к связям нерадикальных катионов с анионами, поскольку именно эти связи определяют механическую (твердость) и термическую (температуру плавления или разложения) стабильность подобных кристаллов. Следует обратить внимание на удовлетворительное согласие (близость) параметров
fi в таблице 2.14 и параметров реальной комплексности e в таблице 2.3 для соответствующих соединений, что может свидетельствовать в пользу идентичности физического смысла обоих параметров.
Итак, из таблиц 2.13-2.15 следует близость (за редким исключением) расчетных и экспериментальных (справочных) данных по твердости и температуре плавления разнообразных кристаллов (минералов), включая и довольно сложные.
Этот результат может рассматриваться в качестве дополнительного подтверждения обоснованных в работе (Зуев, 2005) истинных валентностей (числа валентных электронов) у неметаллов: трехвалентности фтора, пятивалентности хлора, брома и иода в кристаллических галоидах; четырехвалентности кислорода в оксидных кристаллах; четырех- и шестивалентности серы, селена и теллура в сульфидах и их аналогах и присутствие в них металлических связей, повышающих валентность катионных компонентов сверх номинальной стехиометрической.
Продемонстрированный с использованием электроотрицательностей атомов подход может рассматриваться в качестве альтернативного по отношению к другим подходам, изложенным в предыдущих разделах (2.1-2.5), с оговоркой, что он является менее универсальным и применим главным образом к гомоатомным координационным кристаллам.
В качестве обобщающих по материалам 2 главы отметим следующие
выводы.
- В этом разделе книги представлены принципиально новые разработки по энергетической интерпретации обширного комплекса физико-химических свойств минералов (и неорганических кристаллов вообще) самых разнообразных химических классов и структурных типов, что позволяет говорить об универсальности предлагаемых подходов.
- На весьма обширном материале, включающем данные по многим сотням кристаллов, выявлены зависимости их свойств от следующих параметров: структурной рыхлости решеток кристаллов, энергии кристаллической ионной решетки, энергии сцепления образующих кристаллы атомных остовов и связующих электронов, энергии сцепления атомов в кристаллах (энергии атомизации), электроотрицательности атомов.
- Для получения зависимостей свойств свойств кристаллических веществ от указанных энергетических параметров последние трансформированы из мольных в соответствующие удельные объемные и массовые величины, при использовании которых удалось вывести формулы оценки порядка 20 важных физико-химических свойств, включая прочностные, термические, упругие, поверхностные, эмиссионные и др.
- Наличие нескольких взаимно контролирующих подходов к оценке свойств кристаллов позволяет давать надежные прогнозные оценки этих свойств как для известных, так и для мало изученных и вновь создаваемых синтетических материалов.
- Несомненную ценность представляет возможность (в рамках предлагаемых подходов) уточнения того или иного физического свойства кристалла при отсутствии соответствующих экспериментальных данных или их противоречивости согласно разным источникам.
- Разработанные в данном разделе энергетические подходы с выводом соответствующих формул оценки физических свойств кристаллов относятся, строго говоря, к изодесмическим координационным соединениям (с трехмерным распределением в пространстве сильных межатомных связей ионного, металлического и ковалентного типов).
Поэтому оценка прочностных, термических и других свойств анизодесмических кристаллов, обладающих явно выраженными элементами молекулярных структурных мотивов (островного, цепочечного или слоистого типов) в рамках предлагаемых подходов не правомерна (свойства подобных соединений определяются слабыми молекулярным связями).
Равным образом предлагаемые формулы оценки упругих свойств (модулей Е, G, К) мало пригодны для кристаллов с каркасным мотивом структуры (кварц и др.).
Однако подавляющее большинство минералов и неорганических кристаллов вообще характеризуется именно координационным и близким к нему структурным мотивом. Это и дает основание квалифицировать разработанные энергетические подходы к оценке свойств кристаллов как универсальные.